- 11/05最新发布!国家药监局...
- 11/05最新发布!国家药监局...
- 11/05莒县人民医院“乙肝临...
- 11/05丽格学院第六届激光研...
- 11/05远大医药:全球创新激...
- 11/04习总书记最新指示:就...
- 11/04生命科技行业一周速递...
- 11/02六大上市药店5家业绩...
- 11/021—9月医保结算69...
- 11/02辉瑞中国2030战略...
- 01/10所谓的“血液净化疗法...
- 09/11各省美容主诊备案最新...
- 10/222021各省美容主诊...
- 08/07医生怎么联系进修的医...
- 04/10医生60岁该退休吗?
- 03/293月医美行业热点资讯...
- 02/172020医美招聘求职...
- 01/292020医美行业薪酬...
- 10/18习总书记十九大报告对...
- 06/26医疗美容主诊医师备案...
最新发布!国家药监局:「干细胞外泌体」不属于「医疗器械」
时间:2024-11-05 17:34
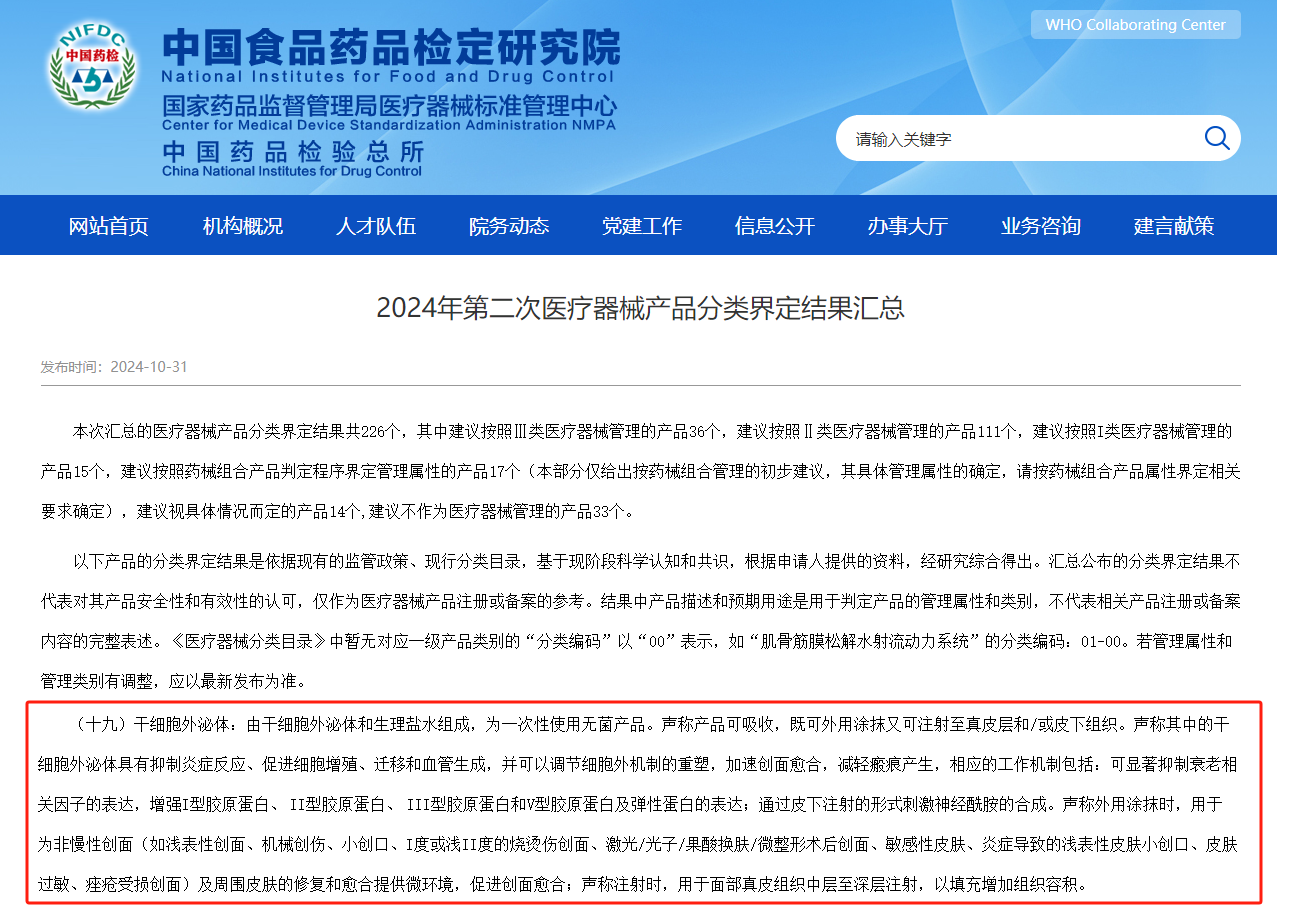
2024年10月31日,国家药品监督管理局医疗器械标准管理中心对外发布《2024年第二次医疗器械产品分类界定结果汇总》。本次披露的分类界定结果共226个,其中建议按照III类医疗器械管理的产品36个,建议按照II类医疗器械管理的产品111个,建议按照I类医疗器械管理的产品15个,建议按照药械组合产品判定程序界定管理属性的产品17个,建议视具体情况而定的产品14个,建议不作为医疗器械管理的产品33个。
公告解读
一、"医疗器械"的定义是指“直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用”。
二、"外泌体"属于供体细胞分泌囊泡,携带有核酸、蛋白、代谢等多种内含成分,通过和细胞进行融合将内含物释放到受体细胞参与生物学调控,包括了药理学、免疫学或者代谢的方式。
三、"干细胞外泌体"是指由干细胞外泌体和生理盐水组成,为一次性使用无菌产品,建议不作为医疗器械管理的产品。
四、"干细胞外泌体"声称产品可吸收,既可外用涂抹又可注射至真皮层和/或皮下组织。干细胞外泌体具有抑制炎症反应、促进细胞增殖、迁移和血管生成,并可以调节细胞外机制的重塑,加速创面愈合,减轻瘢痕产生,相应的工作机制包括:可显著抑制衰老相关因子的表达,增强I型胶原蛋白、 II型胶原蛋白、 III型胶原蛋白和V型胶原蛋白及弹性蛋白的表达;皮下注射时,用于刺激神经酰胺的合成;外用涂抹时,用于为非慢性创面(如浅表性创面、机械创伤、小创口、I度或浅II度的烧烫伤创面、激光/光子/果酸换肤/微整形术后创面、敏感性皮肤、炎症导致的浅表性皮肤小创口、皮肤过敏、痤疮受损创面)及周围皮肤的修复和愈合提供微环境,促进创面愈合;用于注射时,用于面部真皮组织中层至深层注射,以填充增加组织容积。
五、"干细胞外泌体"未来很有可能是要按药品进行管理,期待国家监管机构能明确给出监管办法。
内容来源:国家药监局。文章系本网编辑转载,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。如涉及作品内容、版权和其它问题请联系删除
信息来源于网络,如有侵权,请联系我们,及时删除,如有变更请以原发布者为准。

注册/登录获取更多内容


















 客服
客服 小程序
小程序

 公众号
公众号

 工具箱
工具箱
